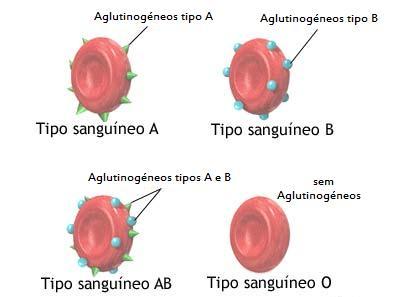
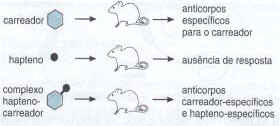
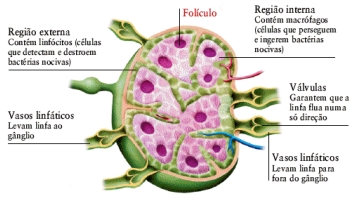
O anticorpo possui uma função importante de se combinar especificamente com o epítopo que ele reconhece, provocando o aparecimento de sinais químicos indicando aos outros componentes do sistema imunitário, que há um invasor no organismo. Alguns anticorpos possuem a capacidade de aglutinar células e precipitar antígenos solúveis. Esta aglutinação facilita a fagocitose do micro-organismo e a precipitação de moléculas estranhas que são agressivas, podem torná-las inócuas.
Existem cinco classes de imunoglobulinas com função de anticorpos, são elas: IgA, IgD, IgE, IgG e IgM. Estas se diferenciam pelas suas propriedades biológicas, localizações funcionais e capacidade de lidar com os diversos antígenos. As imunoglobulinas são moléculas de estrutura tridimensional, sendo que cada uma possui duas cadeias pesadas, unidas a uma cadeia leve cada, através de duas pontes de enxofre e mais duas cadeias pesadas unidas entre si.

A mais abundante na circulação sanguínea é a IgG, constituindo cerca de 75% das imunoglobulinas presentes no plasma. Serve como modelo para as outras classes. Formada por duas cadeias leves idênticas e duas cadeias pesadas, também idênticas, ligadas por pontes de dissulfeto e forças não-covalentes.
A IgA está presente em pequena quantidade na circulação sanguínea. Encontra-se sob a forma de SIgA, sendo o principal anticorpo encontrado na lágrima, no leite, na saliva, nas secreções nasal e bronquial, na secreção presente no lúmen do intestino delgado, na secreção da próstata e também no líquido que umedece a vagina. É muito resistente às enzimas proteolíticas, deste modo, sendo adaptada para atuar nas secreções sem sofrer inativação pelas enzimas presentes nestas.
A IgM constitui 10% dos anticorpos do plasma sanguíneo, existindo na maior parte das vezes, sob a forma de pentâmero (combinação de cinco moléculas). Este imunoglobulina é a predominante no início das respostas imunitárias. Juntamente com a IgD é a mais encontrada na superfície de linfócitos B, exercendo a função de receptoras, combinando com antígenos específicos. O resultado desta combinação é a proliferação destes linfócitos e sua posterior diferenciação em plasmócitos. A IgM livre no sangue, a circulante, pode ativar o complemento, resultando na lise de bactérias.
A IgE, geralmente está na forma de monômero, possui grande afinidade para receptores localizados na membrana de mastócitos e basófilos. Após estas moléculas de imunoglobulinas serem secretadas pelos plasmócitos, elas irão se prender àqueles receptores, praticamente desaparecendo no plasma. A reação alérgica é mediada pela atividade desta imunoglobulina e dos alérgenos que estimulam sua produção. Quando este é encontrado novamente pelo IgE, o complexo antígeno-IgE formada na superfície dos mastócitos e basófilos, determina a produção e a liberação de várias substâncias biologicamente ativas (heparina, histamina, leucotrienos e ECF-A)
A IgD sua função principal ainda não foi esclarecida. Está presente no plasma sanguíneo em concentrações muito baixas, representando apenas 0,2% do total de imunoglobulinas. Esta molécula, juntamente com a IgM, está presente na superfície dos linfócitos B participando da diferenciação desta célula.